服务介绍:
乳腺癌是发生在乳腺上皮组织的恶性肿瘤,根据数据统计近10年中国乳腺癌发病率逐年递增,截止到2018年乳腺癌发病率已跃居第四位,排在肺癌、胃癌之后,严重威胁女性身心安全,新的抗肝癌药物研发意义重大。乳腺癌动物模型能够模拟出人类乳腺癌发病历程,对研究乳腺癌发病机制和临床治疗研究起到较大指导作用。目前实验室采用乳腺原位接种细胞方式构建裸鼠乳腺癌原位瘤模型,并以此模型进行肝癌免疫调节类药物和细胞毒性类药物药效评估。
名称 | 规格 | 价格(元) |
小鼠乳腺癌原位瘤 | 只 | 700起(方案询价) |
实验结果展示:
1、4T1乳腺癌原位瘤剥瘤图

2、BALB/C小鼠乳腺癌原位瘤荷瘤图
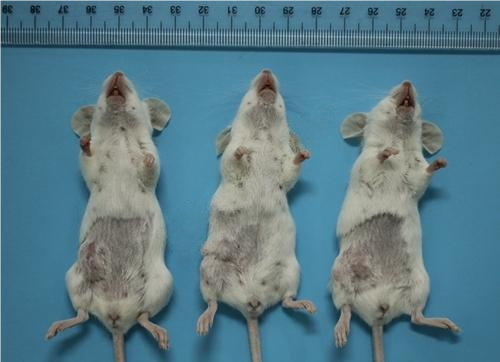
3、乳腺原位接种图

实验流程:
接收方案报价-预付款收取-细胞培养-动物订购-乳腺原位接种-成瘤指标监测-拍照取材-结果发送
送样运输要求:
冻存细胞需要直接寄到平台,尽量避免因温度转换导致细胞出问题
寄送细胞和药品时间:周天-周三,特殊情况需和平台沟通确定,避免出现因未及时收货导致样品出现问题
寄送细胞和样品需要附送送样单(备注清楚细胞名称,培养条件等)



