服务介绍:
人类骨质疏松症(OP)是由于自然衰老(妇女绝经、老年退行性改变)及内分泌紊乱、营养不良及药物诱发等因素而引起的以骨量减少、骨的微观结构退化为特征的,致使骨的脆性增加,易于发生骨折的一种中老年全身性骨骼疾病。
近几年有研究提示,大鼠性成熟、性周期以及切除卵巢后骨量的变化均与大鼠相似,且其骨丧失同样可被雌激素替代疗法所预防。
名称 | 规格 |
大鼠骨质疏松模型 | 只 |
① 动物造模及取材
摘除双侧卵巢
② 表征评估1

体重监测
③ 影像学评估
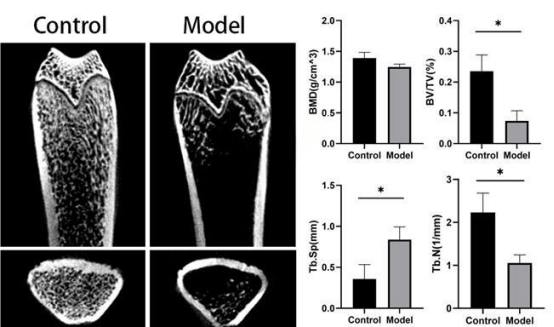
股骨microCT
④ 组织病理学分析1
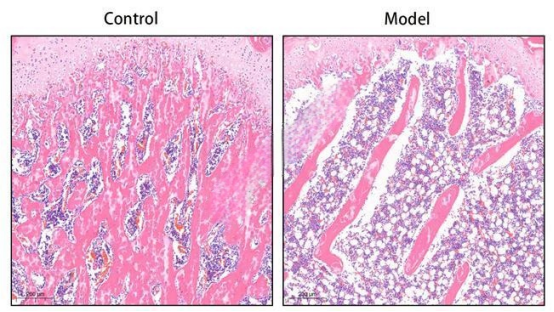
股骨组织脱钙、石蜡包埋、石蜡切片、HE染色、白光扫描
⑤ 表征评估2
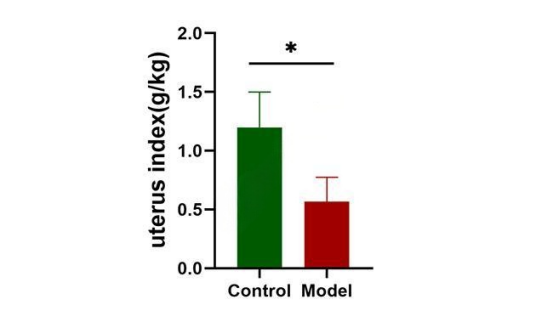
子宫脏器指数
⑥ 组织病理学分析3
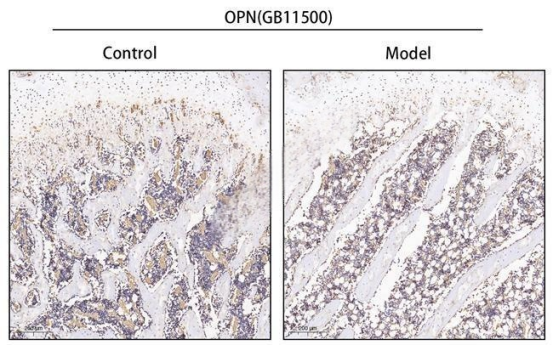
股骨免疫组化指标5选1(推荐指标:OCN/OPN/RUNX2/TRAP/RANKL)
⑦ 组织病理学分析3
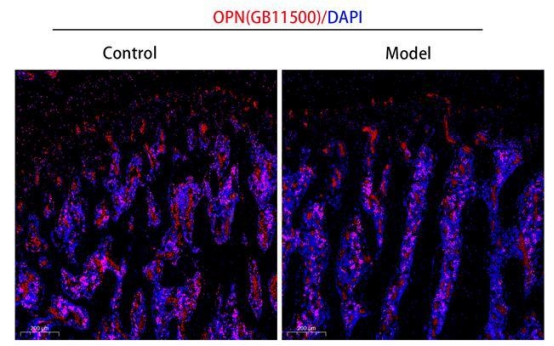
股骨免疫荧光指标5选1(推荐指标:OCN/OPN/RUNX2/TRAP/RANKL)
实验流程:
成年雌性大鼠适应性喂养1周后,摘除双侧卵巢,构建骨质疏松模型。



