服务介绍:
茜素红染料与碳酸钙或磷酸钙中的钙盐螯合形成橙红色复合物。主要是证明组织中钙盐的存在。病理性钙化是相当常见的一种病理变化,例如结核干酪样坏死灶的钙化,主动脉粥样硬化时病变动脉壁的钙化,死的寄生虫卵和其他异物钙化,灶性脂肪坏死的钙化等。
名称 | 规格 | 价格(元) |
茜素红染色 | 张 | 25 |
实验结果展示:
茜素红染色
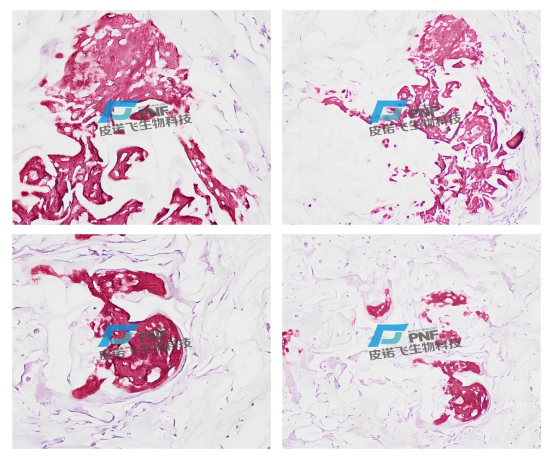
结果判读:
钙盐沉淀出呈红色或橘红色,背景浅红色或近乎无色
实验流程:
脱蜡至水-茜素红染色-脱水封片-显微镜镜检
送样运输要求:
1.样本放置于20倍样本体积的固定液中固定24h以上,常温运输送样。
切勿固定时间过长,切勿冷冻结冰。
2.石蜡切片常温运输,冰冻切片-20℃运输。



