细胞内的联合创造:外泌体、线粒体、巨噬细胞的神秘互动
作者:admin2024-10-18 14:02
热度:1741
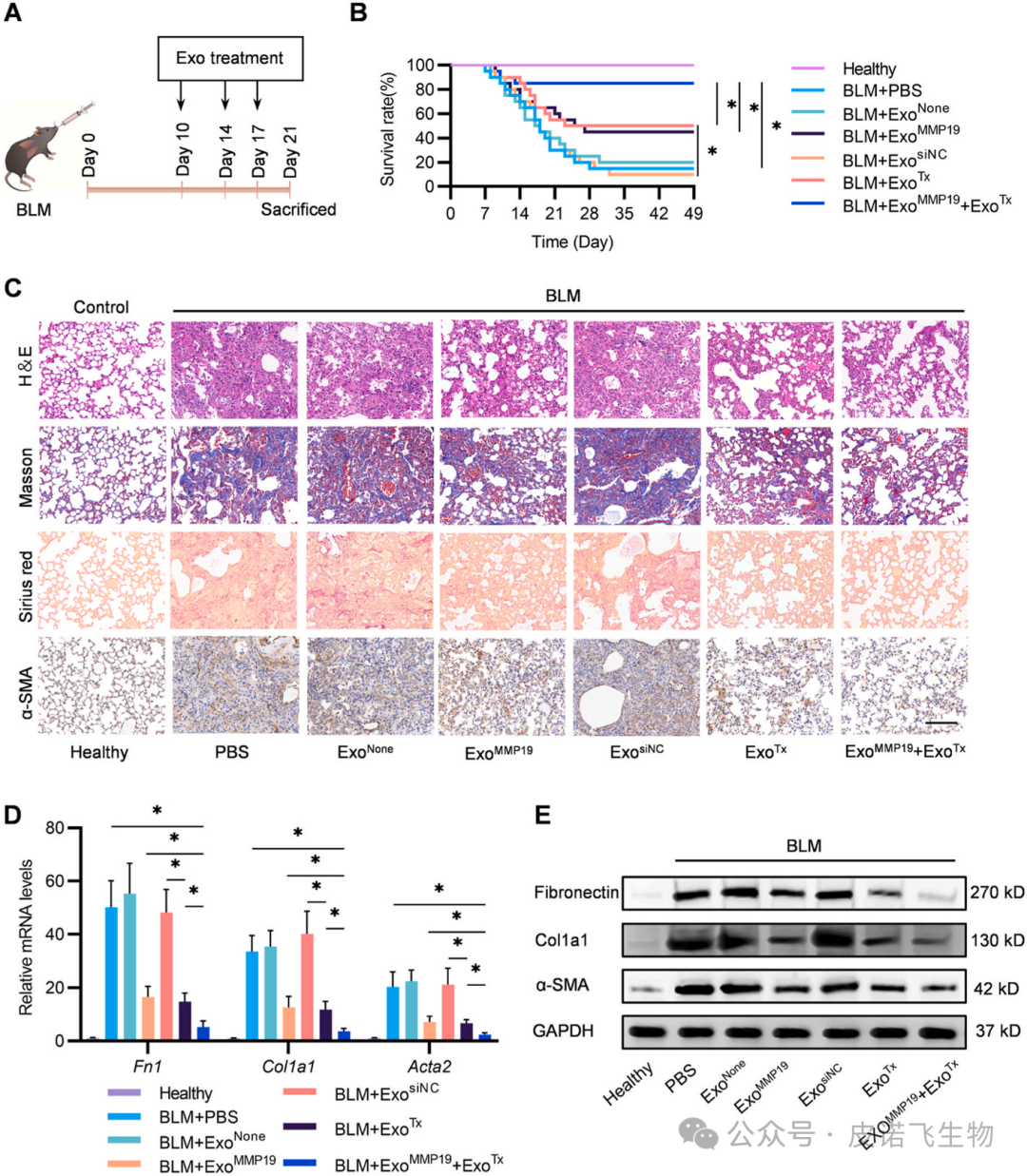
1、本研究敢于大胆假设:受先前研究表明巨噬细胞在肺纤维化(PF)期间增加线粒体生物发生和裂变增加的启发,假设线粒体质量可能作为PF中肺巨噬细胞群体分类的新标志;2、本研究将巨噬细胞重新分类,选择具有高线粒体质量发挥促纤维化功能的亚型,通过敲除Drp1可阻断Mømitohigh的纤维化作用。此外,将siDrp1 递送至 MøMitohigh也可以通过外泌体组合缓解肺纤维化。综合来看,本文构建了一种名为“ExosomeMMP19(ExoMMP19)”的通路外泌体,在其表面显示基质金属蛋白酶-19(MMP19),以局部破坏纤维化肺中过量的细胞外基质(ECM)。此外,从线粒体与巨噬细胞相关性的大热点入手,创新性地筛选巨噬细胞并将siRNA装载Exo靶点,基于Drp1功能搭建机制,为ExoTx的传递铺平道路。题目:促纤维化巨噬细胞靶向通过外泌体配方传递线粒体保护剂,以减轻肺纤维化
公众号关注回复“皮诺飞生物”,可领PDF原文!皮诺飞科技:领先科研技术助力武汉发展!

肺纤维化(PF)是一种毁灭性的肺部疾病,其特征是肺泡上皮损伤、成纤维细胞灶积聚、进行性ECM和胶原沉积。更糟糕的是,PF的预后较差,治疗选择有限。作为细胞动力源,线粒体在信号传导、代谢和细胞死亡的调节中起着至关重要的作用,先前的研究表明,线粒体功能障碍正在成为PF发展的关键病理特征。巨噬细胞在维持免疫稳态和调节适应性炎症反应方面起着关键作用,因此,根据线粒体质量对肺巨噬细胞群进行重新分类可能为巨噬细胞分类提供一种新的方法,并作为治疗PF的有吸引力的治疗策略。鉴于原纤维化巨噬细胞通过启动线粒体裂变对PF发病机制的贡献,靶向Drp1可能是治疗PF的一种有吸引力的治疗方法。此外,外泌体是目前作为药物递送的合理载体出现的,是直径为40-150 nm的细胞外囊泡。既往研究已确定外泌体是潜在的吸入药物载体。本研究首先对pathfinder外泌体ExoMMP19和治疗性外泌体ExoTx进行了设计。基于PTGFRN和生物素-亲和素系统,构建了一种新型的治疗性外泌体ExoTx,通过靶向Mømitohigh中的Drp1来治疗PF。此外,鉴于肺纤维化间质,MMP19,家族内肽酶可以降解ECM在肺中,通过融合蛋白MMP19-PTGFRN-Flag,允许MMP19-PTGFRN-Flag-修饰外泌体(ExoMMP19)破坏生物屏障和ExoTx交付。 1.肺巨噬细胞群可分为低线粒体质量(Mømitolow)巨噬细胞和高线粒体质量(Mømitohigh)巨噬细胞为了阐明肺巨噬细胞线粒体质量的差异,研究者们测量了野生型C57BL/6小鼠和博莱霉素(BLM)诱导的PF小鼠肺中的线粒体质量。值得注意的是,BLM诱导的PF小鼠的巨噬细胞中的线粒体质量增加(图1B)。接下来,对BLM诱导的小鼠的肺Mømitolow和Mømitohigh群体进行分类,并使用qRT-PCR检测促纤维化细胞因子的相对mRNA水平(图1A)。结果显示,与Mømitolow相比,Mømitohigh中转化生长因子1(Tgfβ1)、血小板衍生生长因子(Pdgfα)、几丁质酶3样1(Chi3l1)、肿瘤坏死因子(Tnfα)、白细胞介素1(IL1β)和细胞通信网络因子2(Ccn2)显著增加。对不同表达基因(DEGs)的分析显示,Mømitohigh中有3842个基因显著高于Mømitolow(图1C)。基因集合富集分析(GSEA)显示,它们在参与线粒体裂变正调控的通路中富集,并显著参与了线粒体质量的调控(图1D)。此外,这些基因的表达显著上调(图1E)。为了验证这些发现,研究者进行了qRT-PCR,验证了Drp1是Mømitohigh中表达最多的基因(图1F)。
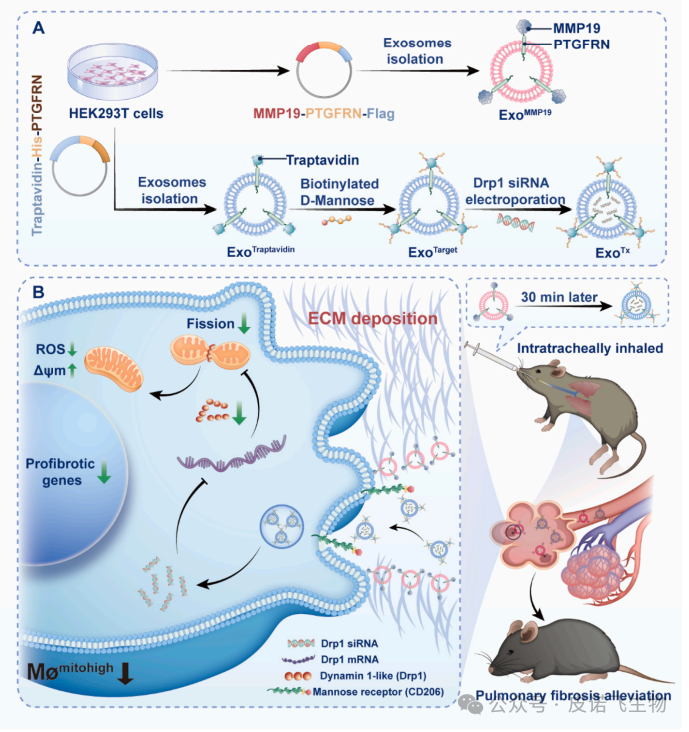
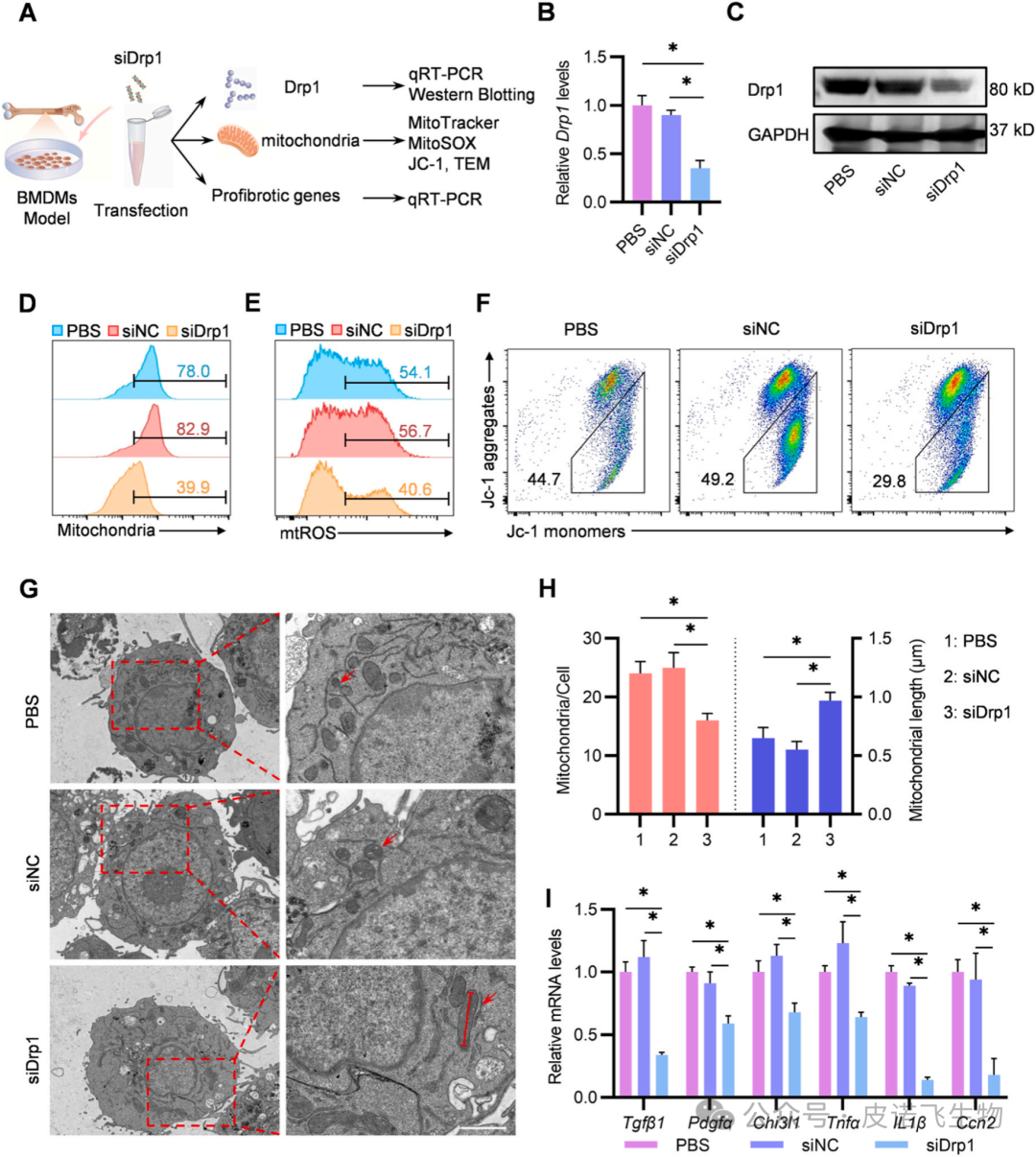
图1 Drp1在PF小鼠的Mømitohigh中高表达2.抑制Drp1可以恢复线粒体功能障碍,降低体外纤维化基因的表达为了进一步阐明Drp1与线粒体质量、线粒体功能和促纤维化基因之间的关系,用BLM暴露的MLE-12上清液处理BMDM,然后用siDrp1转染48 小时(图 2 A)。首先,使用qRT-PCR和蛋白质印迹法分析Drp1的mRNA和蛋白水平。结果显示,siDrp1组的mRNA和蛋白水平显著低于PBS组和siNC组(图2B和C)。图2D 表明,siDrp1 组在用BLM暴露的MLE-12上清液处理的BMDM中具有较低的线粒体质量。接下来,评估了Drp1在调节BMDM中 mtROS和Δψm中的作用。在本研究中,发现敲低Drp1下调mtROS水平,同时上调BMDM中的Δψm水平(图 2E 和 F)。此外,使用透射电子显微镜(TEM)评估了线粒体的形态,还发现与其他组相比,siDrp1组的BMDM表现出线粒体减少但线粒体长度增加(图2G和H)。鉴于 Tgfβ1、Pdgfα、Chi3l1、Tnfα、IL1β 和 Ccn2 显著参与 PF,在进一步的实验中,验证了 Drp1 是否调控这些纤维化基因的表达。结果显示,与对照组相比,siDrp1显著下调了这些纤维化基因的mRNA水平(图2 I)。上述结果表明,Drp1在线粒体功能调控和促纤维化基因表达中起关键作用。
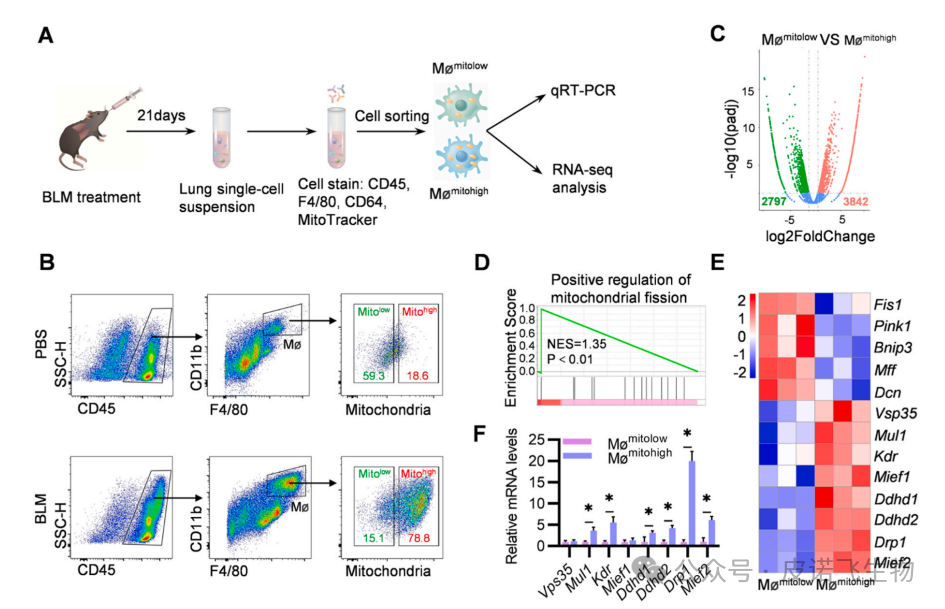
图2 干扰Drp1逆转线粒体功能障碍,下调促纤维化基因为了区分两个表型不同的巨噬细胞群体,通过RNA-Seq分析和qRT-PCR进一步确定了Mømitolow和Mømitohigh之间表面基因的差异表达。图3A、B显示,Mømitohigh与Mømitolow相比高表达的前20个细胞表面基因中,CD206、CD86、CD80、CD163、CD200R表达最高,CD206的基因表达上调最显著。接下来,分析了BLM诱导的小鼠肺CD206+巨噬细胞与Mømitohigh之间的相关性(图3C)。这些发现表明,与M1/M2范式不同,CD206+巨噬细胞可能代表Mømitohigh亚群。考虑到Mømitohigh中CD206和Drp1表面标记物显著增加,可以确定Drp1在CD206+巨噬细胞中是否增加(图3C)。通过对BLM诱导的PF小鼠的肺CD206+巨噬细胞和CD206-巨噬细胞进行分类,并用qRT-PCR检测其Drp1 mRNA水平,发现CD206+巨噬细胞中Drp1水平高于CD206-巨噬细胞。Drp1也被发现过表达,这可以通过相肌肌动蛋白(α-SMA)和I型胶原a1(Col1a1)双阳性纤维化肺组织中CD206+巨噬细胞的荧光强度增加来证明(图3E)。
4.siDrp1负载的外靶蛋白(ExoTx)可减轻线粒体功能障碍和抑制纤维化基因的表达接下来,BLM诱导的小鼠被迫用PBS/ExosiNC/ExoTx进行气管内吸入。48 h后,采用流式细胞术检测BLM诱导小鼠肺CD206+巨噬细胞的线粒体质量。值得注意的是,与PBS组和ExosiNC组相比,ExoTx降低线粒体质量更显著(图4A)。此外,TEM显示ExoTx中的肺巨噬细胞与对照组相比,表现出更少的线粒体和增加的线粒体长度(图4B和C)。然后,通过流式细胞术对BLM诱导小鼠的肺CD206巨噬细胞进行分选,并进行qRT-PCR分析(图4D)。与预期的一样,结果显示ExoTx显著下调了Drp1 mRNA(图4E)。与siDrp1在体外的作用一致,ExoTx也显著下调了CD206+巨噬细胞中Tgfβ1、Pdgfα、Chi3l1、Tnfα、IL1β和Ccn2的mRNA水平(图4F)。综上所述,ExoTx在体外和体内治疗的结果表明,抑制巨噬细胞中的Drp1基本上是抑制纤维化基因的一种可行方法。
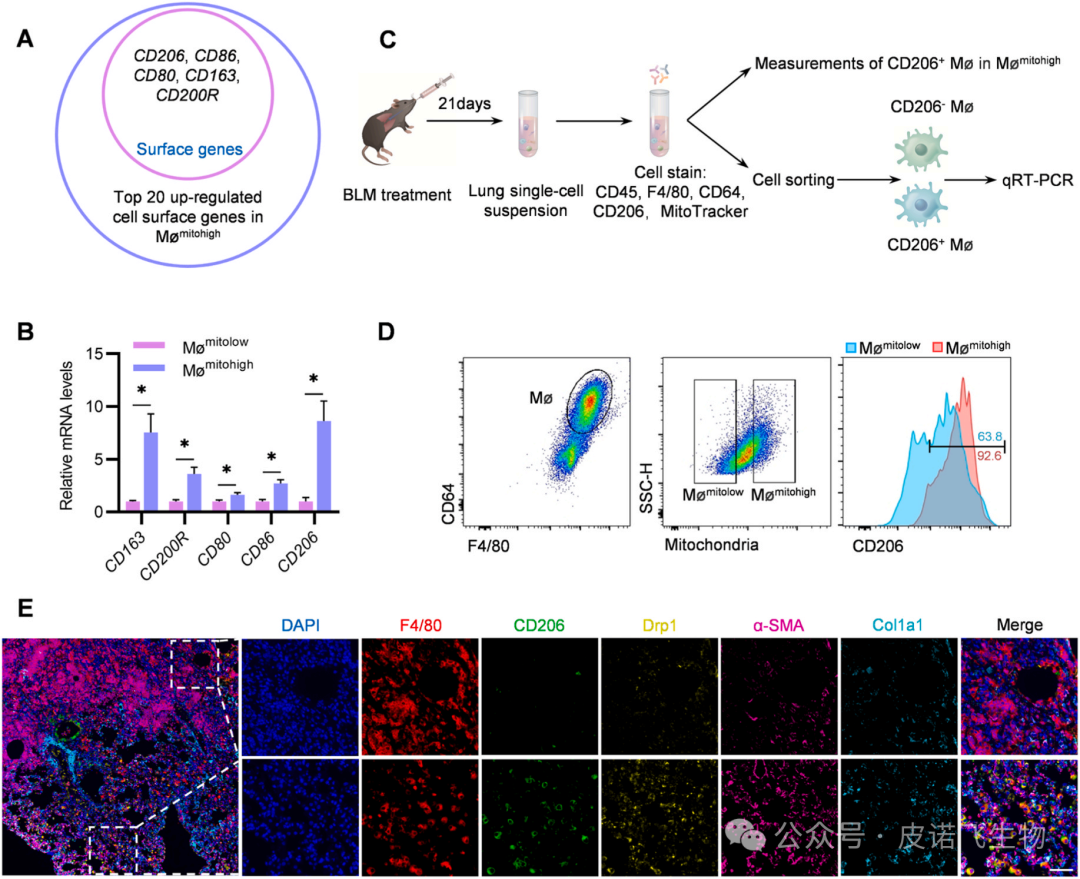
图4 ExoTx在体内降低线粒体质量,下调促纤维化基因为了确定ExoMMP19是否能降解ECM,研究者们将PBS/ ExoNone/ExoMMP19添加到小鼠成纤维细胞L929细胞中(图5A)。Western blot结果显示,ExoMMP19显著降低了L929细胞中纤维连接蛋白、Col1a1和α-SMA的表达(图5B)。接下来,为了评估外泌体在体内的分布,将DiR标记的外泌体吸入肺,使用IVIS测量DiR标记的外泌体的分布(图5C)。值得注意的是,与对照组相比,ExoMMP19具有更强的在肺内积累的能力(图5D)。然后使用免疫荧光追踪DiI标记的外泌体(图5E),结果显示ExoMMP19定位于胶原标记的较少纤维化区域,而对照组的外泌体与纤维化区域重叠,表明ExoMMP19降解了过度的胶原(图5F和G)。由于纤维化肺中过多的ECM可以阻止外泌体到达纤维化区域,因此在小鼠吸入ExoNone/ExoMMP19后30分钟,将DiI标记的ExoTarget给予BLM小鼠,以评估靶向CD206+巨噬细胞的效果(图5H)。如图5I和J所示,在ExoTarget+ExoMMP19组中,F4/80和CD206双阳性细胞中DiI的荧光强度与ExoTarget + ExoNone组相比显著增强。流式细胞术也显示ExoMMP19提高了ExoTarget靶向CD206+巨噬细胞的功效(图5K)。综上所述,这些发现表明ExoMMP19可以潜在地作为肺纤维化治疗的探路者。
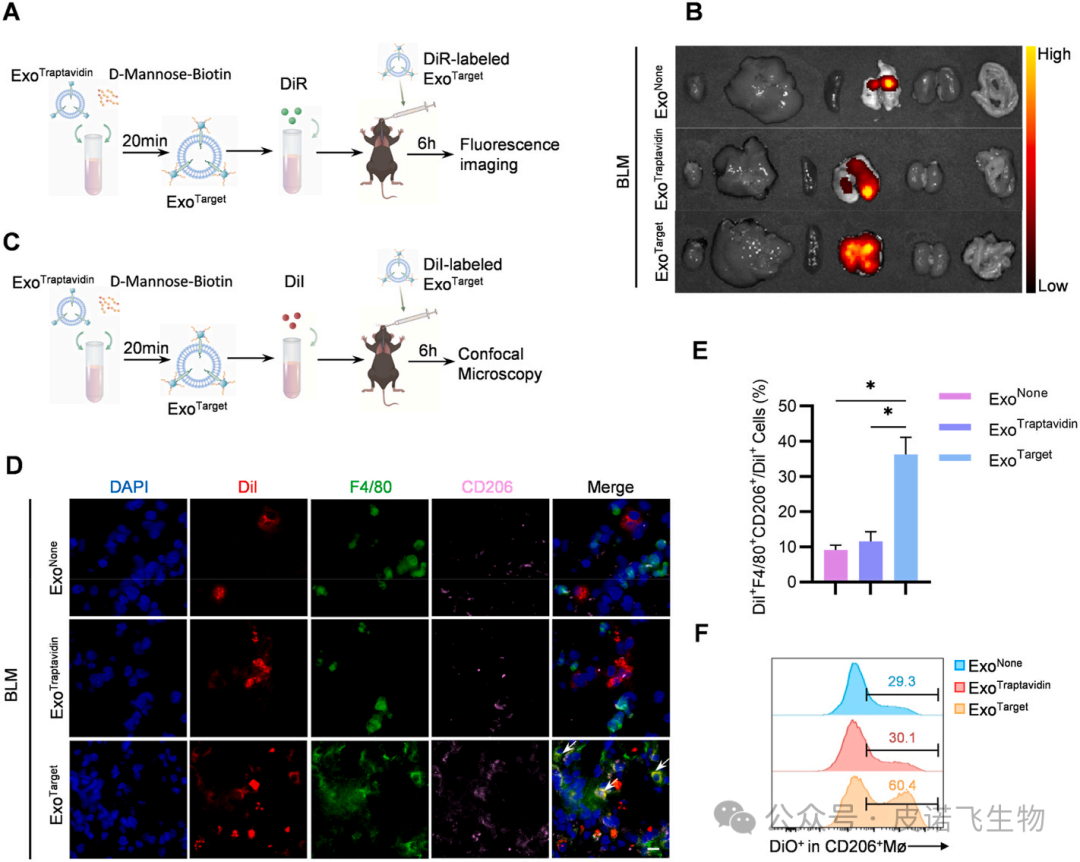
图5 ExoMMP19降解了过量的ECM,提高了ExoTarget的靶向效果