
荧光定量PCR
一.荧光定量PCR技术原理以及应用?
二.操作流程及图解
(1)主要步骤概述:
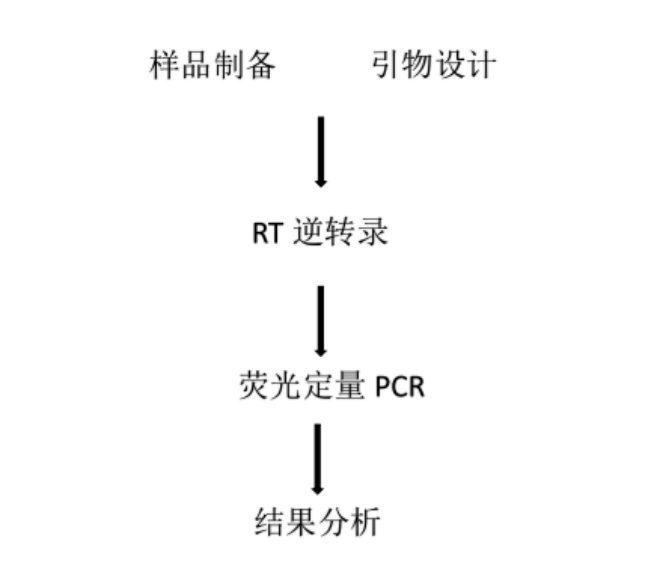
(2)详细图解步骤
A.样本收集并裂解:
B.样本裂解好的样品加氯仿分层:
C.加酒精沉淀:
D.浓度测定:

E.反转录:
(1)基因组DNA去除:
Reagent | Volume(μl) |
4×gDNA wiper rMix | 4 |
Total RNA | 4μg |
Nuclease-Free Water | Up to16 |
反应条件:用移液器轻轻吹打混匀。42℃2min.
(2)配制逆转录反应体系:
在第一步的反应管中直接加入5×HiScripII qRT SuperMix II
Reagent | Volume(μl) |
5×HiScripII qRT SuperMix II | 4 |
第1步的反应液 | 16 |
反应条件:
温度 | 时间 |
50℃ | 15min |
85℃ | 5s |
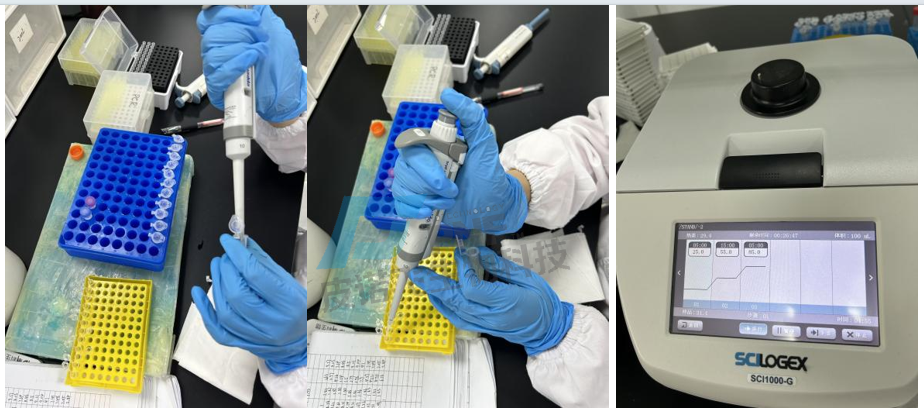
F.QPCR上机:
(1)配制反应体系:
Component | |
Forward Primer (10μM) | 0.4μl |
Reverse Primer (10μM) | 0.4μl |
2×Taq Pro Universal SYBR qPCR Master Mix | 10μl |
Template DNA/cDNA | 2μl |
H2ONuclease-Free Water | to20μl |
(2)设置反应程序:
项目 | 温度 | 时间 | 循环数 | |
预变性 | 95℃ | 30sec | 1 | |
变性 | 95℃ | 10sec | 40 | |
退火/延伸 | 60℃ | 30sec | ||
熔解曲线采集 | 95℃ | 15sec | 1 | |
60℃ | 60sec | |||
95℃ | 15sec | |||

三.教会你怎样看懂结果?
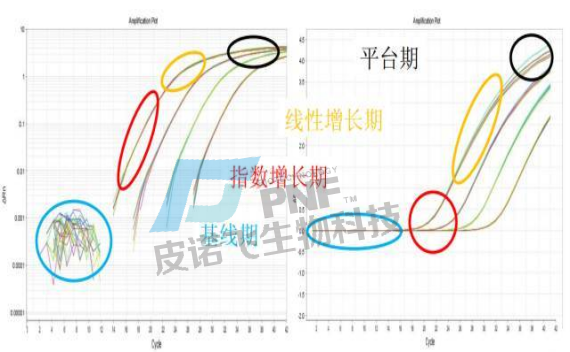
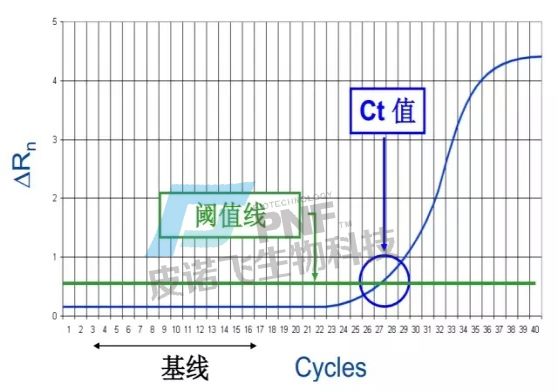
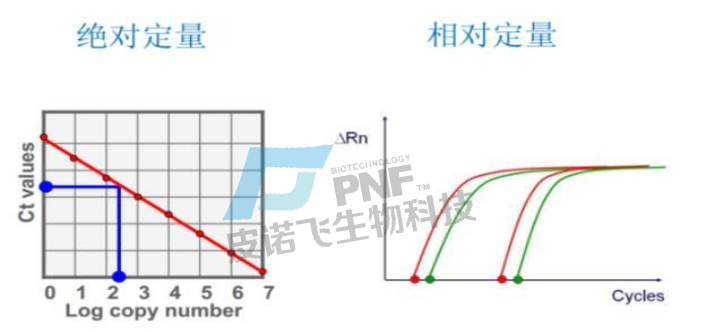
A.扩增曲线:在PCR扩增反应的最初数个循环里,荧光信号变化不大,接近一条直线,这样的直线即是基线,这条线是可以自动生成也可以手动设置的。之后反应会进入指数增长期,这个期间扩增曲线具有高度重复性,在该期间,可设定一条荧光阈值线,它可以设定在荧光信号指数扩增阶段任意位置上,但一般会将荧光阈值的缺省设置是 3-15 个循环的荧光信号的标准偏差的10 倍。每个反应管内的荧光信号到达设定的阈值时所经历的循环数被称为CT值,这个值与起始浓度的对数成线性关系,且该值具有重现性。
Ct值最大的意义就是用来计算目的基因的表达量,此时就有两个概念容易被提及,那就是绝对定量和相对定量,绝对定量的目的是测定目的基因在样本中的分子数目,即通常所说的拷贝数。相对定量的目的是测定目的基因在两个或多个样本中的含量的相对比例,而不需要知道它们在每个样本中的拷贝数。
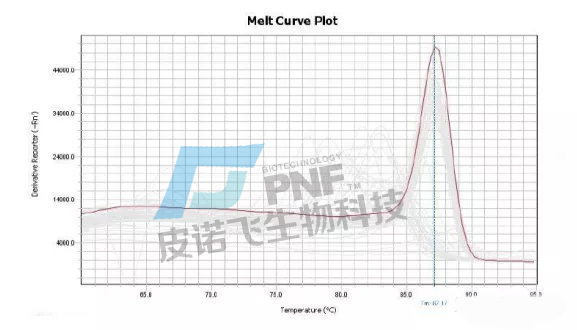
B.溶解曲线:通过判断基因的融解曲线峰形是否为单一窄峰,即可判定该基因qPCR扩增体系是否特异。染料法荧光定量,基因的融解曲线必须为单峰,定量结果才为准确。
C.CT值:Ct值诚然可以被利用来计算这两种定量结果,但是绝对定量实验必须使用已知拷贝数的绝对标准品,必须做标准曲线。相对定量可以做标准曲线,也可以不做标准曲线。绝对标准品制作困难难以获取,实验室基本都是选择相对定量的方法来计算相对基因表达量。
四.常见问题以及解答?
1.曲线图不会看,如何理解?可以简单解释下吗?
扩增曲线:实时荧光PCR由于每个循环要监测荧光信号值,因此都有拟合好的扩增曲线。
熔解曲线:总的DNA双螺旋结构降解一半的温度称为熔解温度(Tm),不同序列的DNA,Tm值不同。DNA中G-C含量越高,Tm值越高,成正比关系。
2.Excel表中每列标题代表意义?哪个反应mRNA的表达量?文章中写结果看哪列?组间比较用哪列?单位是什么?
△CT=CT目的基因-Ct内参基因
△△CT=△CT实验-△CT对照
扩增倍数=2-△△CT,扩增倍数即为基因的表达倍数;每个编号代表每个样本的相关数据,可根据表达量对样本进行比较,没有单位。
3.只看柱状图可以反应组内及组间变化趋势吗?
柱状图是根据样本间计算的公式做的图,是根据实验事实得出来的,可以很好的反应变化趋势
4.如何理解“内参”?相对含量可以代表实际表达量吗?
1.内参即是内部参照,它们在各组织和细胞中的表达相对恒定,在检测基因的表达水平变化时常用它来做参照物。其作用是校正上样量、上样过程中存在的实验误差,保证实验结果的准确性。借助检测每个样品内参的量就可以用于校正上样误差,这样定量的结果才更为可信。一般要选择一个在处理因素作用的条件下不会发生表达改变的基因作内参。
2.不能说等同.只是能作为表达量的一种表现形式,实际上是转录水平的表达量
5.内参基因:常见的内参有哪些?
常用的内参基因包括GAPDH、β-actin(BETA-actin)、18sRNA、B2M、HPRT和TBP等。